Een nieuw experimenteel antibioticum kan gemakkelijk een van ‘s werelds beruchtste medicijnresistente en dodelijke bacteriën vernietigen – tenminste in laboratoriumschalen en muizen. Het doet dit op een ongekende manier, waardoor een hele nieuwe klasse medicijnen ontstaat die in de broodnodige nieuwe therapieën zou kunnen voorzien om medicijnresistente infecties te bestrijden.
De bevindingen verschenen deze week in een paar artikelen gepubliceerd in het tijdschrift Nature, die uitgebreid medicijnontwikkelingswerk vertegenwoordigen door onderzoekers van de Harvard University en het Zwitserse farmaceutische bedrijf Roche.
In een begeleidend commentaar bespraken de scheikundigen Morgan Gugger en Paul Hergenrother van de Universiteit van Illinois in Urbana-Champaign de bevindingen optimistisch, waarbij ze opmerkten dat het meer dan 50 jaar geleden is dat de Food and Drug Administration een nieuwe klasse antibiotica goedkeurde tegen de categorieën antibiotica. bacteriën waarop het medicijn zich richt: Gram-negatieve bacteriën. Deze categorie, die darmpathogenen omvat, zoals E coli, Salmonella, Shigellaen de bacteriën die chlamydia, builenpest, gonorroe, kinkhoest, cholera en tyfus veroorzaken, om er maar een paar te noemen, zijn uiterst moeilijk te doden omdat ze worden gedefinieerd door een complexe membraanstructuur die de meeste medicijnen blokkeert en goed is in het accumuleren van andere medicijnen. resistentiestrategieën
Een belangrijke bevinding
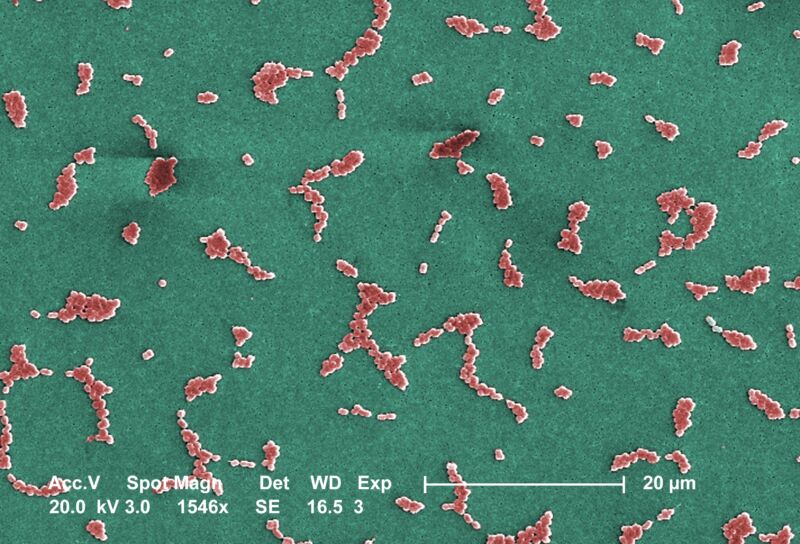
In dit geval bestrijdt het nieuwe medicijn, zosurabalpin genaamd, carbapenem-resistente gramnegatieve bacteriën Acinetobacter baumannii, ook wel KANKER genoemd. Hoewel het misschien onduidelijk klinkt, is het een opportunistische, invasieve bacterie die vaak gehospitaliseerde en ernstig zieke patiënten treft en wereldwijd dodelijke infecties veroorzaakt. Het is in hoge mate resistent tegen geneesmiddelen, met de voortdurende opkomst van pan-resistente stammen over de hele wereld – met andere woorden, stammen die resistent zijn tegen alle momenteel beschikbare antibiotica. Sterftecijfers als gevolg van invasieve CRAB-infecties variëren van 40 tot 60 procent. In 2017 noemde de Wereldgezondheidsorganisatie het als prioriteit 1: kritische ziekteverwekker, waarvoor nieuwe antibiotica het meest dringend nodig zijn.
Zosurabalpin zou wel eens het dringend noodzakelijke medicijn kunnen zijn, zoals Gugger en Hergenrother in hun commentaar schrijven: ‘Nu zosurabalpin al in klinische onderzoeken wordt getest, ziet de toekomst er veelbelovend uit, met de mogelijkheid dat er eindelijk een nieuwe klasse antibiotica aan de horizon verschijnt. invasieve CRAB-infecties.”
Een internationaal team van onderzoekers, onder leiding van Michael Lobritz en Kenneth Bradley van Roche, was de eerste die via een ongebruikelijk scherm een voorloper van zosurabalpin identificeerde. De meeste nieuwe antibiotica zijn kleine moleculen, met een molecuulgewicht van minder dan 600 dalton. Maar in dit geval doorzochten de onderzoekers een verzameling van 45.000 grotere, zwaardere verbindingen, de zogenaamde gekoppelde macrocyclische peptiden (MCP’s), die ongeveer 800 dalton wegen. De moleculen werden getest tegen een verzameling gramnegatieve stammen, waaronder een A. baumannii deformatie. Een groep verbindingen schakelde de bacteriën uit, en de onderzoekers kozen voor degene bovenaan – met het handige handvat RO7036668. Het molecuul wordt vervolgens geoptimaliseerd en verfijnd, inclusief ladingsbalancering, om het effectiever, oplosbaarder en veiliger te maken. Dit resulteerde in zosurabalpin.
Een dodelijk medicijn
In verdere experimenten bleek zosurabalpin effectief te zijn bij het doden van een verzameling van 129 klinische RABA-isolaten, waarvan er vele moeilijk te behandelen isolaten waren. Het experimentele medicijn was ook effectief bij het bevrijden van muizen van infecties met pan-resistente A. baumannii isolaat, wat betekent dat, hoe effectief het medicijn ook is, het bestaande resistentiemechanismen kan omzeilen.
Vervolgens gingen de onderzoekers op zoek Hoe zosurabalpin doodde deze dodelijke panresistente bacteriën. Ze deden dit met behulp van de standaardmethode om bacteriën te onderwerpen aan verschillende concentraties antibiotica om spontane mutaties te induceren. Voor bacteriën die tolerantie voor zosurabalpin ontwikkelden, gebruikten de onderzoekers sequencing van het hele genoom om te identificeren waar de mutaties zich bevonden. Ze vonden 43 verschillende mutaties, en de meeste daarvan bevonden zich in de genen die coderen voor de machinerie voor het transport en de biosynthese van LPS.